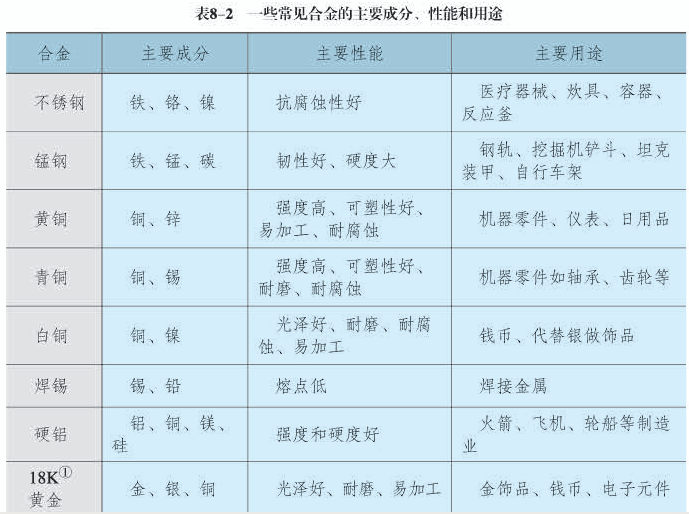
金属活动性指金属单质在水溶液中失去电子生成金属阳离子的倾向,属于热力学范畴。
利用金属活动性,可以比较金属在水中(而不是其他环境或干态)的还原性强弱与其对应的阳离子的氧化性强弱,预测水中一系列的置换反应的方向。
一般来说,元素周期表内元素从上到下,从右到左有活动性增强趋势,其本质原因是随着金属半径增大,最外层电子数减少,其电离能与升华能均有下降,虽水合热亦有下降,但前两者已足够弥补。但对于一些特殊的例子,如锂,由于其半径极小,水合热足够高,弥补了升华热与电离能偏高的不足,导致它在水中的活动性甚至比铯还要高。
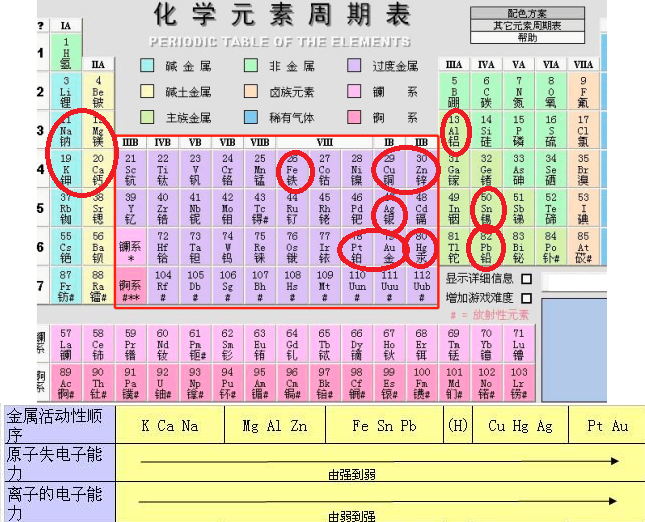
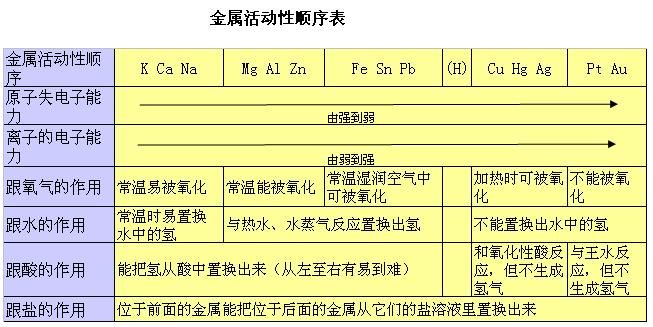
金属活动性顺序:钾、钙、钠、镁、铝、锌、铁、锡、铅、氢、铜、汞、银、铂、金。
即K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au。
在金属活动顺序表中,金属活动性是由强逐渐减弱,一般位置越后的金属,金属性越弱,原子的还原性越弱。例如:金属活动性:Sn>Pb,但元素的金属性:Pb>Sn。
由金属活动性顺序表可以得到以下结论:
1、排在前面的金属可以将排在后面的金属从它们的金属溶液中置换出来。(若金属过于活泼,则会直接与水反应,并不会与水中的金属离子反应);
2、理论上讲,金属活动性表中铁及排在其前的金属均可置换出纯水中的氢;
3、若只考虑氢离子的氧化性,排在氢前的金属才能和非氧化性酸反应,置换出氢;
4、排在越后的金属越容易,也越先从它们的化合物中被置换出来;排在越前的金属越容易,也越先把其他化合物中的金属置换出来。
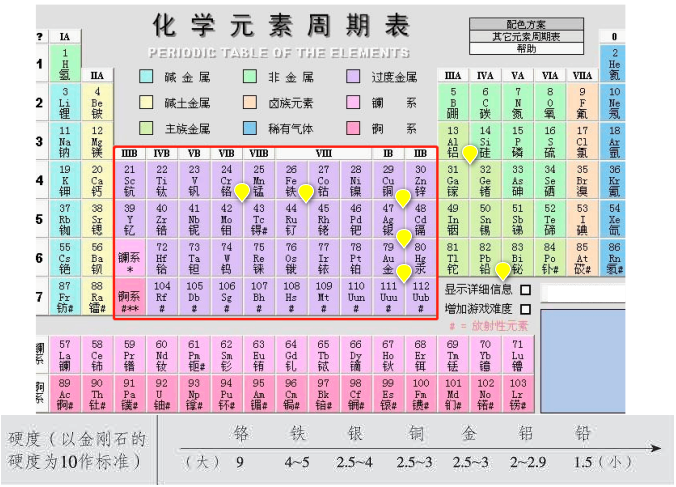
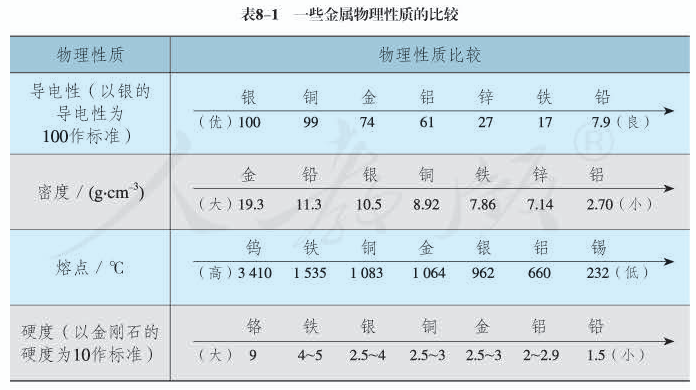
1.金属的硬度取决于金属中金属键的强弱;
2.金属原子的半径越小,金属键越强,硬度越大;
3.单位体积内的金属的价电子数越多,金属键越强,硬度越大。 一般来讲,对主族金属,从左到右,同周期,原子半径减小,价电子数增多, 所以硬度增大;
4.从上到下,同主族,原子半径增大,价电子数相同,所以硬度减小;
5.对于过渡元素,从左到右,半径减小,但是价电子数先增多后减小,因此规律可能就没有主族那么明显,但是,硬度较大的元素一般处于同周期过渡元素的中部。
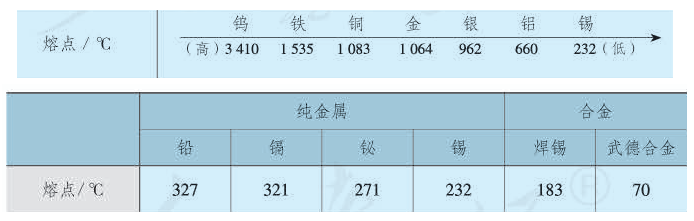
熔沸点在元素周期表中的规律:同一周期元素随原子序数的递增, 元素组成的金属单质的熔点递增,非金属单质的熔点递减; 同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。
金属晶体的熔、沸点变化规律:
在金属晶体中,金属原子是靠自由电子和金属离子间的相互作用结合在一起的,金属熔化时,金属键并没有被破坏,只是原子间的距离略有增大,当液态金属变为气体时,金属键完全被破坏,分离成单个原子(碱金属蒸气中有少量M2分子),因此,金属的沸点往往比熔点高得多。
1.同周期金属的价电子越多,熔、沸点越高。
金属晶体内自由电子数增多,金属键合能力增强,欲使金属熔化或气化则需较高温度。如Na、Mg、Al,参与成键的电子数增多,且半径减小,故熔、沸点依次升高。
金属晶体的熔、沸点变化规律:
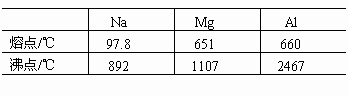
2.同主族金属的半径越大,熔、沸点越低。
同主族金属价电子数相同,半径的增大使得金属键减弱,导致熔、沸点降低,如碱金属从Li到Cs,熔点由180.5℃依次降低,Cs的熔点仅28.4℃,放在手心上就可以熔化。
以上两条规律仅对次外层是稀有气体结构的典型金属是适用的。过渡金属的熔、沸点都很高,熔点普遍超过1000℃,沸点大部分高达3000℃,其中钨的熔点是3380℃,沸点是5927℃,产生这种现象的原因是d电子参与成键,使金属键增强。铜副族因还有部分d电子较活泼,其熔、沸点仍较高,但锌副族的d电子稳定,其熔、沸点明显下降,此后进入了低熔区,低熔区金属的价电子虽不少,但活动性差,不能全部成为自由电子,金属键弱,导致熔、沸点低。
金属键是阳离子与电子之间较强的作用,简单地说,类似于静电作用,所以金属键与金属原子的自由电子数和金属原子半径有关。
影响金属键强弱的因素:
(1)金属原子半径增大,键越弱。
(2)金属原子最外层电子数越多,键越强。
例如:Li、Na、K、Rb、Cs金属键依次减弱。